Cultura
Breve guida all’ammoniaca e ai suoi usi

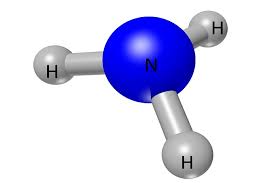
L’ammoniaca è un composto chimico di formula NH3, che si presenta come un gas incolore, tossico e dall’odore pungente. È molto solubile in acqua e ha proprietà basiche. L’ammoniaca ha molti usi nell’industria chimica, sia come reagente che come prodotto intermedio.
Uno degli usi principali dell’ammoniaca è la produzione di fertilizzanti contenenti azoto, che sono essenziali per l’agricoltura mondiale. L’ammoniaca reagisce con l’acido fosforico per formare il fosfato di ammonio, con l’acido nitrico per formare il nitrato di ammonio, o con il calcio per formare il calcio nitrato di ammonio. Questi composti forniscono azoto alle piante, che ne hanno bisogno per la crescita e la fotosintesi. L’ammoniaca può anche essere applicata direttamente al suolo come soluzione acquosa.
Un altro uso importante dell’ammoniaca è la sintesi dell’acido nitrico, che a sua volta è usato per produrre nitroderivati per l’industria degli esplosivi, dei coloranti e delle materie plastiche. L’ammoniaca reagisce con l’ossigeno in presenza di un catalizzatore di platino per formare monossido di azoto, che poi viene ossidato ad anidride nitrica e infine idrolizzato ad acido nitrico.
L’ammoniaca ha anche altre applicazioni nell’industria chimica, come la produzione di etanoloammine, idrazina, urea, cianammide, acrilammide e altri composti organici contenenti azoto. Inoltre, l’ammoniaca viene usata come fluido refrigerante nei sistemi di refrigerazione industriale, grazie alla sua elevata capacità di assorbire calore durante la vaporizzazione.
L’ammoniaca trova impiego anche in altri settori, come l’industria alimentare, dove viene usata per produrre biossido di carbonio utile nella carbonatazione delle bevande, nella lievitazione degli impasti e nella conservazione degli alimenti. L’ammoniaca viene anche usata in tintoria e concia per modificare il pH delle soluzioni e migliorare la fissazione dei coloranti e dei tannini. Infine, l’ammoniaca ha proprietà detergenti e disinfettanti ed è usata in alcuni prodotti per la pulizia domestica e industriale.
Secondo i dati della International Fertilizer Association (IFA), la produzione mondiale di ammoniaca nel 2020 è stata di circa 180 milioni di tonnellate, con la Cina che ha rappresentato il 36% del totale, seguita da India (9%), Russia (8%), Stati Uniti (7%) e Canada (4%). La domanda mondiale di ammoniaca è prevista in crescita nei prossimi anni, soprattutto per soddisfare le esigenze dell’agricoltura e della produzione di acido nitrico.
Come si produce l’ammoniaca
L’ammoniaca si produce a partire da azoto e idrogeno, secondo il processo Haber-Bosch, che consiste nella reazione diretta tra i due elementi a temperature elevate (400-500 °C) e alte pressioni (150-300 atm), in presenza di un catalizzatore a base di ferro. La reazione è esotermica e reversibile, quindi si deve operare in condizioni ottimali per spostare l’equilibrio verso la formazione di ammoniaca.
N2(g) + 3H2(g) ⇌ 2NH3(g) ΔH = -92 kJ/mol
L’idrogeno necessario per il processo si ricava dal syngas, una miscela gassosa di idrogeno e monossido di carbonio, che si ottiene per reforming del metano (gas naturale) o del carbone con vapore d’acqua e aria. Il syngas viene poi purificato da CO, CO2, H2S e altri composti indesiderati prima di essere inviato al reattore di sintesi dell’ammoniaca.
Il metano reagisce con il vapore d’acqua a circa 800 °C in presenza di un catalizzatore a base di nichel, producendo syngas con una proporzione H2/CO di circa 3:1.
CH4(g) + H2O(g) ⇌ CO(g) + 3H2(g)
Il monossido di carbonio reagisce con il vapore d’acqua a circa 400 °C in presenza di un catalizzatore a base di ossido di ferro e ossido di cromo, producendo anidride carbonica e idrogeno. Questa reazione è detta spostamento del gas d’acqua e aumenta la proporzione H2/CO nel syngas.
CO(g) + H2O(g) ⇌ CO2(g) + H2(g)
L’anidride carbonica viene eliminata dal syngas per lavaggio con soluzioni alcaline o ammine. L’idrogeno solforato viene eliminato per lavaggio con soluzioni di zinco o ferro. Altri composti solforati vengono eliminati per adsorbimento su carbone attivo o allumina. Il monossido di carbonio viene eliminato per conversione catalitica in metano.
CO(g) + 3H2(g) ⇌ CH4(g) + H2O(g)
L’azoto necessario per il processo si ricava dall’aria per frazionamento criogenico, che consiste nel raffreddare l’aria fino a temperature molto basse (-200 °C) e separare i suoi componenti per distillazione frazionata. L’azoto rappresenta circa il 78% dell’aria ed è il componente più volatile.
L’ammoniaca prodotta nel reattore di sintesi viene separata dalla miscela gassosa residua per condensazione e successiva distillazione frazionata. La miscela gassosa residua viene riciclata al reattore dopo aver aggiunto idrogeno fresco.





Pingback: Sicurezza alimentare: chiude l'ultimo impianto di ammoniaca nel Regno Unito. A rischio i fertilizzanti