EnergiaScienza
La rivincita del Manganese: come un metallo “povero” risolve il problema dello stoccaggio dell’Idrogeno (e umilia i metalli preziosi)
Scienziati USA rivoluzionano la catalisi: un nuovo metodo usa il manganese per convertire la $CO_2$ in carburante, superando per efficienza e costi i metalli preziosi. Una svolta per l’idrogeno.

Spesso, quando si parla di transizione energetica, ci scontriamo con un muro di costi proibitivi. Le tecnologie “green”, per quanto affascinanti sulla carta, tendono a dipendere da materiali rari, costosi e geopoliticamente sensibili. Platino, iridio, palladio: nomi che fanno tremare i bilanci industriali e sorridere i paesi esportatori. Tuttavia, ogni tanto, la chimica di base ci regala una sorpresa che ha il sapore della democratizzazione energetica. Un nuovo studio condotto dall’Università di Yale e dall’Università del Missouri ha dimostrato che il manganese, un metallo abbondante ed economico, può fare il lavoro dei metalli preziosi, e spesso farlo meglio.
Al centro della scoperta c’è la capacità di trasformare l’anidride carbonica ($CO_2$) in formiato, un vettore liquido fondamentale per l’idrogeno. E il segreto sta tutto in una “tenaglia” molecolare.
Il dilemma dell’Idrogeno e la soluzione del Formiato
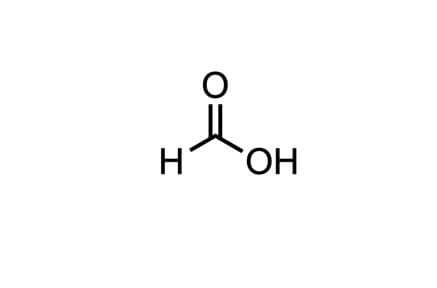
Tutti amano l’idrogeno, almeno in teoria. È pulito, potente e, se usato nelle celle a combustibile, produce solo acqua. Ma c’è un problema logistico enorme: stoccarlo. L’idrogeno è un gas leggerissimo, difficile da comprimere e trasportare. Qui entra in gioco l’acido formico (e la sua forma protonata idrogenata, il formiato).
Immaginate il formiato come una “batteria liquida” chimica. Se riusciamo a prendere la radice della molecola e aggiungerci idrogeno, otteniamo formiato. Questo liquido può essere stoccato facilmente, trasportato con le infrastrutture esistenti e, al momento del bisogno, utilizzato per rilasciare idrogeno per le celle a combustibile.
Fino ad oggi, però, convertire la radice nel formiato richiedeva catalizzatori a base di metalli nobili. Usare metalli vili (come il ferro o il manganese) portava a risultati deludenti: i catalizzatori si “rompevano” e smettevano di funzionare quasi subito. O almeno, così era fino a ieri.
La svolta tecnica: il Manganese con la “cintura di sicurezza”
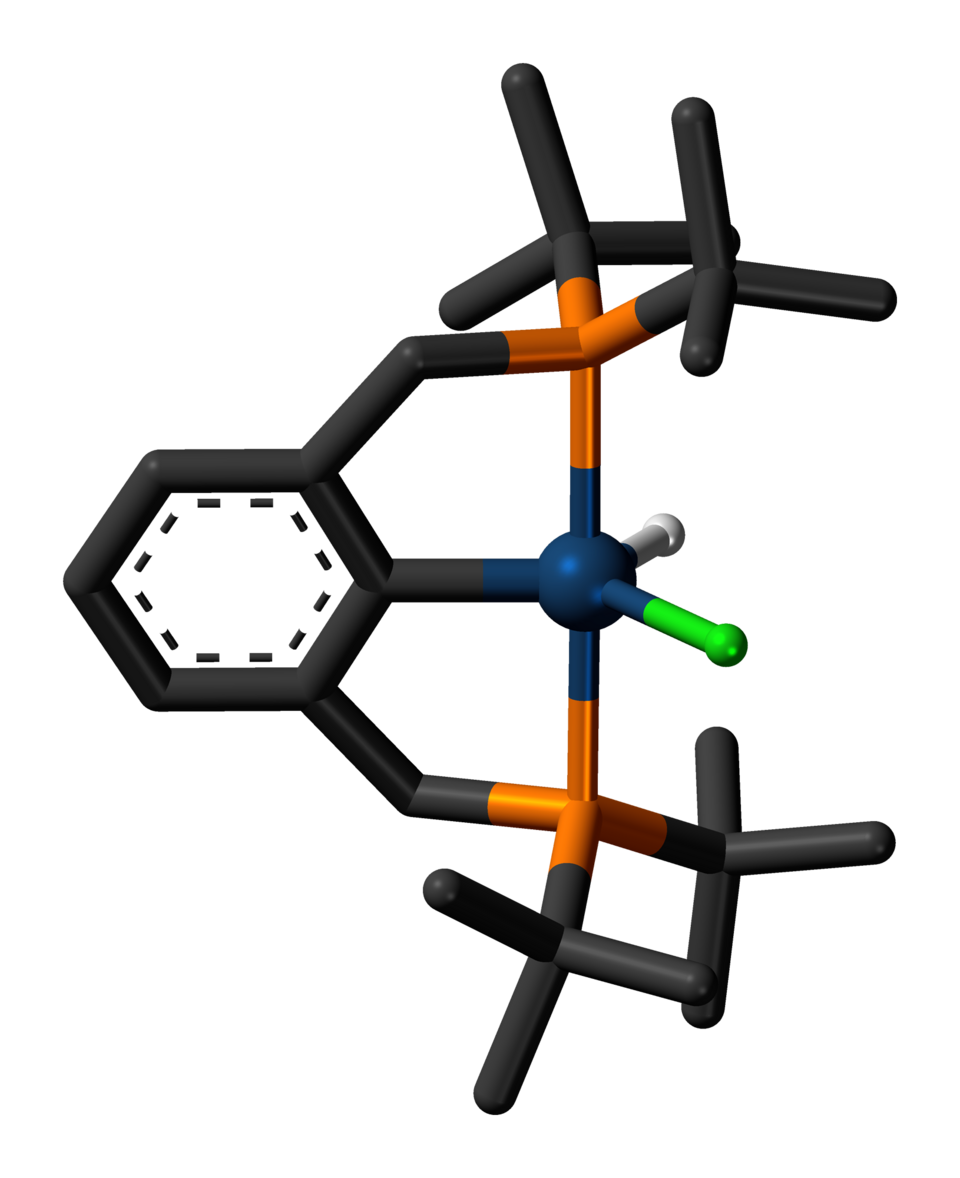
I ricercatori Justin Wedal (Yale) e Kyler Virtue (Missouri), sotto la guida dei professori Nilay Hazari e Wesley Bernskoetter, hanno pubblicato su Chem un approccio innovativo. Hanno preso un catalizzatore a base di manganese e hanno ridisegnato la sua struttura molecolare.
Per capire l’innovazione, bisogna guardare al diagramma del processo. I catalizzatori utilizzano dei leganti (ligands), ovvero molecole che si legano all’atomo di metallo centrale per influenzarne la reattività.
Il team ha sviluppato quello che in gergo tecnico si chiama legante a tenaglia (Pincer Ligand) dotato di un “donatore emilabile” aggiuntivo.
Semplifichiamo:
- I catalizzatori economici tendono a essere instabili e a decomporsi durante la reazione violenta di idrogenazione.
- I ricercatori hanno aggiunto un “braccio” extra alla molecola (il donatore emilabile).
- Questo braccio agisce come una sorta di cintura di sicurezza: si attacca e si stacca reversibilmente dal centro metallico (il manganese), stabilizzandolo nei momenti critici ed evitando che la molecola si disgreghi.
I numeri che umiliano i metalli preziosi
Il risultato non è stato solo un “funziona”, ma un “funziona meglio”. I dati riportati nello studio sono impressionanti per chi mastica chimica industriale:
- TON (Turnover Number): Il catalizzatore ha raggiunto un numero di turnover fino a 838.000. Questo indica quante volte il catalizzatore può completare il ciclo di reazione prima di esaurirsi.
- TOF (Turnover Frequency): La velocità di reazione ha toccato i 158.000 cicli all’ora
Per mettere questi numeri in prospettiva: questi valori superano le prestazioni della maggior parte dei catalizzatori basati su metalli preziosi attualmente noti. Stiamo parlando di ottenere prestazioni da Ferrari al prezzo di un’utilitaria.
Perché questa scoperta è economicamente rilevante?
In un’ottica macroeconomica e industriale, questa scoperta tocca tre tasti dolenti dell’attuale paradigma energetico:
- Indipendenza dalle materie prime critiche: Il manganese è il dodicesimo elemento più abbondante nella crosta terrestre. Non è controllato da oligopoli ristretti come il platino o le terre rare. Passare da catalizzatori nobili al manganese significa abbattere i costi di investimento iniziale (CAPEX) per gli impianti di produzione di idrogeno/formiato.
- Economia Circolare della $CO_2$: Utilizzare l’anidride carbonica come “ingrediente” invece che come scarto è il Santo Graal della chimica verde. Se il processo di conversione diventa economico (grazie al manganese), la cattura della $CO_2$ industriale diventa un business case sostenibile, non solo un obbligo normativo.
- Scalabilità: L’acido formico è già prodotto su scala industriale (usato come conservante o nella concia delle pelli), ma oggi deriva dai combustibili fossili. Produrlo da $CO_2$ e idrogeno verde apre a un mercato enorme, che va oltre le celle a combustibile, toccando l’industria chimica di base.
Le prospettive future: non solo idrogeno
“Sono entusiasta di vedere che il design del legante ha dato frutti così significativi”, ha dichiarato Justin Wedal, uno degli autori principali. E ha ragione. Il principio scoperto – l’uso di un braccio stabilizzatore “emilabile” – non si applica solo a questa specifica reazione.
È una proof of concept che potrebbe essere estesa ad altre reazioni chimiche industriali che oggi dipendono da catalizzatori costosi. I ricercatori suggeriscono che questi principi di design potrebbero migliorare i catalizzatori per una vasta gamma di trasformazioni chimiche, rendendo i processi industriali meno costosi e meno tossici.
Certo, come sempre accade nella scienza, dal laboratorio all’impianto pilota c’è di mezzo il mare dell’ingegnerizzazione. Bisognerà vedere come il sistema reagirà su scale massicce e in condizioni operative reali continuative. Ma il segnale è chiaro: la chimica “povera”, se guidata da un design intelligente, può competere ad armi pari con i giganti della tavola periodica.
In un mondo che cerca disperatamente di decarbonizzare senza deindustrializzare, sapere che possiamo contare sul manganese invece che sul palladio è una notizia che dovrebbe far piacere non solo agli ambientalisti, ma anche ai direttori finanziari.






You must be logged in to post a comment Login